有些化合物与底物的化学结构和分子几何结构非常相似,与底物共存时,会与底物分子竞争相同的酶活性位点,但是没有反应发生。这类物质称为酶促反应的竞争性抑制剂。
被竞争性抑制剂“鸠占鹊巢”的酶,无法再与底物分子结合。但是,如果底物分子足够多,以压倒性数量优势打败竞争对手,那么竞争性抑制通常是可逆的。
因此,酶被抑制的程度取决于抑制剂的浓度,底物的浓度以及抑制剂和底物对活性位点的相对亲和力大小。
竞争性抑制最常见,磺胺类药物就是竞争性抑制剂,如对氨基苯磺胺。它与对氨基苯甲酸相似,可抑制细菌二氢叶酸合成酶,从而抑制细菌生长繁殖。人体可利用食物中的叶酸,而细菌不能利用外源的叶酸,所以对此类药物敏感。抗菌增效剂TMP可增强磺胺的药效,因为其结构与二氢叶酸类似,可抑制细菌二氢叶酸还原酶,但很少抑制人体二氢叶酸还原酶。它与磺胺配合使用,可使细菌的四氢叶酸合成受到双重阻碍,严重影响细菌的核酸及蛋白质合成。
2 非竞争性抑制剂
非竞争性抑制剂是与酶形成强共价键的物质,因此可能不会因添加过量底物而被置换。非竞争性抑制剂可以结合在活性位点,附近或远离活性位点。在任何情况下,酶的基本结构都会被修饰到停止工作的程度。
如果抑制作用位于远离活性位点的位置,则称为变构抑制作用。变构的意思是“其他位点”或“其他结构”。抑制剂在变构位点的相互作用改变了酶的结构,因此活性位点也发生了变化。
由于许多酶包含巯基(-SH),醇或酸基团作为其活性位点的一部分,因此任何可与它们反应的化学物质均会作为非竞争性抑制剂。Ag +,Hg2 +,Pb2 +等重金属对-SH基团具有很强的亲和力,是典型的非竞争性抑制剂。
相关题目:
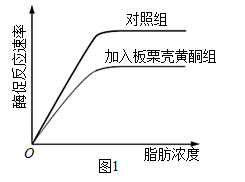
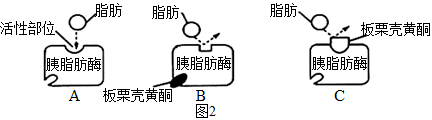
胰脂肪酶是肠道内脂肪水解过程中的关键酶,板栗壳黄酮可调节胰脂肪酶活性进而影响人体对脂肪的吸收。为研究板栗壳黄酮对胰脂肪酶活性的影响,科研人员进行了下列实验。